அடுத்ததாக எப்படி ஒரு மூலக்கூறினை எழுதுவது? தண்ணீர் என்றால் H2 O என அறிவோம். அது போன்று ஓவ்வொரு மூலக்கூறு எழுதும்போது அதனுடைய விதியை பின்பற்றி எழுதினால் எளிதாக முடியும்.
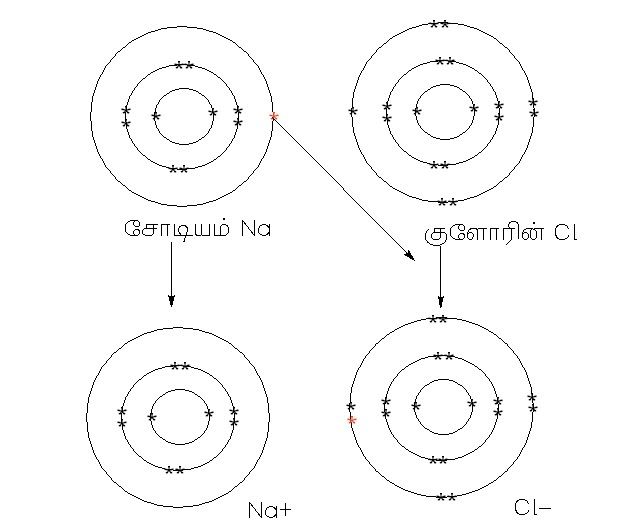
உதாரணமாக சோடியம் தன்னால் ஒரு எலக்ட்ரான் மட்டுமே இழக்க முடியும் எளிதாக ஆக குளோரினுடன் இணையும்போது NaCl என எழுதிவிடலாம், ஆனால் இரண்டாவது குழுவில் உள்ள கால்சியத்துடன் குளோரின் இணைவதை CaCl என எழுதினால் தவறாகிவிடும். காரணம் கால்சியம் தனது வெளிவட்ட ஆர்பிட்டாலில் இரண்டு எலக்ட்ரான்கள் இழக்கும் தன்மை உடையது. எனவே இரண்டு குளோரின்கள் தேவைப்படும் ஆக CaCl2 என எழுதுவதே சரியாகும். இது போன்று சோடியம் ஆக்ஸிஜனுடன் இணையும் போது Na2O எனவும் கால்சியம் ஆக்ஸிஜனுடன் இணையும் போது CaO எனவும் எழுத வேண்டும்.
உதாரணமாக சோடியம் தன்னால் ஒரு எலக்ட்ரான் மட்டுமே இழக்க முடியும் எளிதாக ஆக குளோரினுடன் இணையும்போது NaCl என எழுதிவிடலாம், ஆனால் இரண்டாவது குழுவில் உள்ள கால்சியத்துடன் குளோரின் இணைவதை CaCl என எழுதினால் தவறாகிவிடும். காரணம் கால்சியம் தனது வெளிவட்ட ஆர்பிட்டாலில் இரண்டு எலக்ட்ரான்கள் இழக்கும் தன்மை உடையது. எனவே இரண்டு குளோரின்கள் தேவைப்படும் ஆக CaCl2 என எழுதுவதே சரியாகும். இது போன்று சோடியம் ஆக்ஸிஜனுடன் இணையும் போது Na2O எனவும் கால்சியம் ஆக்ஸிஜனுடன் இணையும் போது CaO எனவும் எழுத வேண்டும்.
ஆக்ஸிஜனேற்ற எண்களை நினைவு கொள்வது மிகவும் சுலபம். முதலில் ஒரு அணுவானது எந்த நிலையில் நிலை பெற்று உள்ளது என்பதை எண்ணத்தில் கொள்ள வேண்டும். குரூப் 1 என்றால் +1 குரூப் 2 என்றால் +2 என செல்லும். டி பிளாக்கில் இருக்கும் அணுக்கள் பல ஆக்ஸிஜனேற்ற எண்களைப் பெற்று இருக்கும் என்பதால் அதனை மட்டும் தனியாய் பார்ப்போம்.
நமக்கு மிகவும் தேவையான உபயோகப்படுகிற மூலக்கூறுகளைப் பார்த்து விடுவோம். அதாவது பி பிளாக்கில் உள்ள அணுக்கள் குறிப்பாக ஆக்ஸிஜன் இரண்டு எலக்ட்ரான்களை பெறுவதால் பூர்த்தி நிலை அடைவதால் -2 என எண்ணை பெறுகிறது. நைட்ரஜன் இருவித நிலையை கொண்டு உள்ளது.
இப்படி அணுக்களில் உள்ள எலக்ட்ரான்களைப் பொருத்து அதனுடைய மூலக்கூறுகள் வடிவமைப்பை பெற்றுக் கொள்கின்றன. இந்த வடிவமைப்புகள் சில வட்டத்திற்குள் அமைந்துவிடுவதால் அதிக வேறுபாடுகள் என காண்பது அரிது. இவை எளிமையான மூலக்கூறுகளுக்கு மட்டுமே என கருதுகிறேன். எப்படி வடிவமைப்பை கொண்டுள்ளது என்பதை பார்க்கும் முன்னர் சில ஆக்ஸிஜனேற்ற விதிவிலக்குகளையும் பார்த்து விடலாம்.
நமக்கு மிகவும் தேவையான உபயோகப்படுகிற மூலக்கூறுகளைப் பார்த்து விடுவோம். அதாவது பி பிளாக்கில் உள்ள அணுக்கள் குறிப்பாக ஆக்ஸிஜன் இரண்டு எலக்ட்ரான்களை பெறுவதால் பூர்த்தி நிலை அடைவதால் -2 என எண்ணை பெறுகிறது. நைட்ரஜன் இருவித நிலையை கொண்டு உள்ளது.
இப்படி அணுக்களில் உள்ள எலக்ட்ரான்களைப் பொருத்து அதனுடைய மூலக்கூறுகள் வடிவமைப்பை பெற்றுக் கொள்கின்றன. இந்த வடிவமைப்புகள் சில வட்டத்திற்குள் அமைந்துவிடுவதால் அதிக வேறுபாடுகள் என காண்பது அரிது. இவை எளிமையான மூலக்கூறுகளுக்கு மட்டுமே என கருதுகிறேன். எப்படி வடிவமைப்பை கொண்டுள்ளது என்பதை பார்க்கும் முன்னர் சில ஆக்ஸிஜனேற்ற விதிவிலக்குகளையும் பார்த்து விடலாம்.
உதாரணமாக H2O2 இதில் பார்த்தோமானால்
O = 2x-1 = -2
H = 2x1 = 2
என இருந்தால் தான் இது முழுமை பெற்ற ஒரு மூலக்கூறுவாக இருக்க முடியும், ஆனால் H தன்னிடம் ஒரு எலக்ட்ரான் மட்டுமே பெற்று உள்ளது.
O = 2x-1 = -2
H = 2x1 = 2
என இருந்தால் தான் இது முழுமை பெற்ற ஒரு மூலக்கூறுவாக இருக்க முடியும், ஆனால் H தன்னிடம் ஒரு எலக்ட்ரான் மட்டுமே பெற்று உள்ளது.
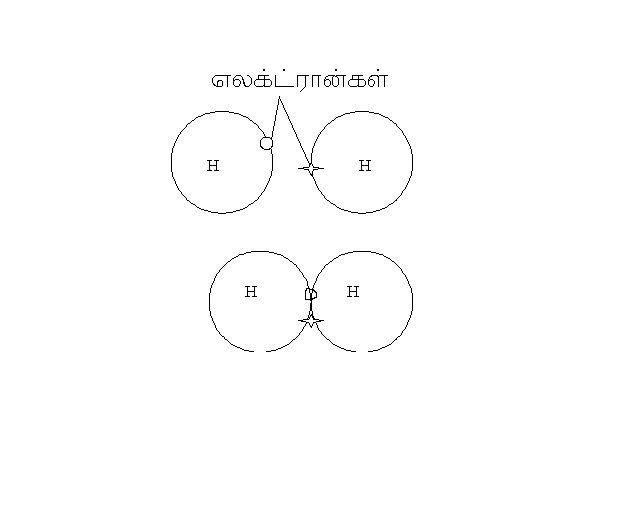
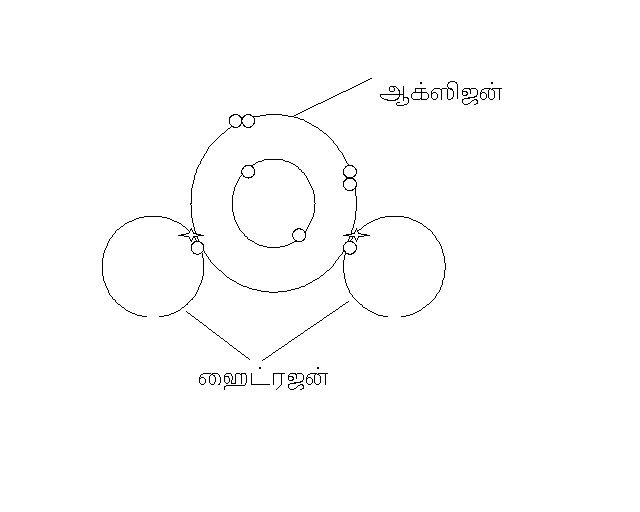
முழுமை பெறுவது என்பது s2p6 என்ற அமைப்பை பொறுத்தது எனச் சொல்வார்கள். ஆக்ஸிஜனுக்கு 2 எலக்ட்ரான்கள் தேவை. ஹைட்ரஜனுக்கு 1 எலக்ட்ரான் தேவை , எனவே நீர் மூலக்கூறில் ஆக்ஸிஜன் இரு எலக்ட்ரான்களை ஒவ்வொரு எலக்ட்ரான்கள் கொண்டுள்ள ஹைட்ரஜனுடன் பரிமாறிக்கொண்டு, தானும் முழுமை பெற்று, ஹைட்ரஜனும் முழுமை பெறுகிறது.
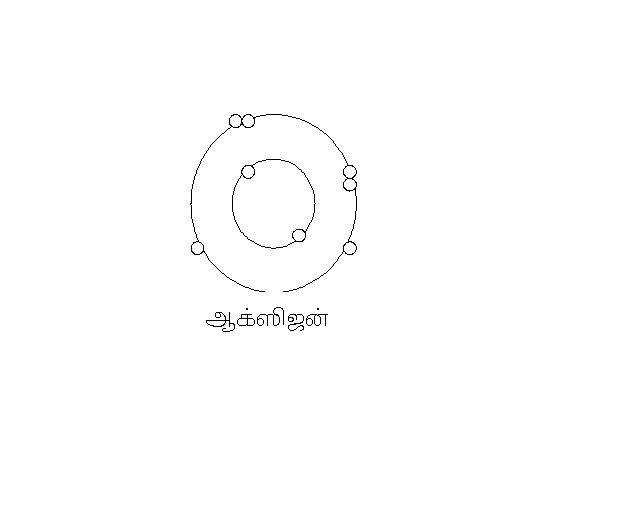
ஆக்ஸிஜன் - அணு எண் 8 2, 2,4 (2வேண்டும் முழுமை பெற)
ஹைட்ரஜன் - அணு எண் 1 1 (1 வேண்டும் முழுமை பெற)
ஆக்ஸிஜன் - அணு எண் 8 2, 2,4 (2வேண்டும் முழுமை பெற)
ஹைட்ரஜன் - அணு எண் 1 1 (1 வேண்டும் முழுமை பெற)
மேலும் ஒரு உதாரணம் NaH
இது என்னவெனில் Na +1 அமைப்பு கொண்டது, H +1 அமைப்பு கொண்டது, இப்படி +1+1 எழுதினால் கூட்டுத்தொகை +2 ஆக வரும், எனவே NaH+2 என எழுதினால் மட்டுமே முறை, ஆனால் இது மூலக்கூறு, எனவே NaH என்றுதான் எழுத வேண்டும். எனவே ஆக்ஸிஜனேற்ற எண்கள் இப்படி அமைகிறது.
Na = +1
H = -1
இனி அமைப்புகள் பற்றி பார்க்கும்முன்னர் எப்படி எலக்ட்ரான்கள் அணி வகுத்துக் கொள்கின்றன என்பதை பார்த்துவிடுவோம்.
இது என்னவெனில் Na +1 அமைப்பு கொண்டது, H +1 அமைப்பு கொண்டது, இப்படி +1+1 எழுதினால் கூட்டுத்தொகை +2 ஆக வரும், எனவே NaH+2 என எழுதினால் மட்டுமே முறை, ஆனால் இது மூலக்கூறு, எனவே NaH என்றுதான் எழுத வேண்டும். எனவே ஆக்ஸிஜனேற்ற எண்கள் இப்படி அமைகிறது.
Na = +1
H = -1
இனி அமைப்புகள் பற்றி பார்க்கும்முன்னர் எப்படி எலக்ட்ரான்கள் அணி வகுத்துக் கொள்கின்றன என்பதை பார்த்துவிடுவோம்.
H-O-O-H இப்படித்தான் ஹைட்ரஜன் பெராக்ஸைடு மூலக்கூறு வாய்ப்பாடு அமைகிறது. இதில் எப்படி ஹைட்ரஜன் இரண்டு எலக்ட்ரான்கள் தருவது போல் அமைய முடியும் என்று பார்த்தால் சற்று கடினம்தான். ஆனால் இந்த மூலக்கூறு மிகவும் நிலைத்தன்மையுடையது அல்ல. ஒரு மூலக்கூறு என எடுத்துக் கொண்டால் மொத்த ஆக்ஸிஜனேற்ற தன்மையானது 0 வாகத்தான் இருக்கும்.
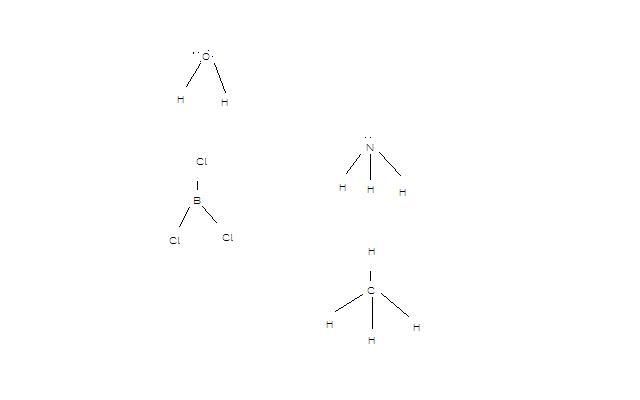
தண்ணீர் மூலக்கூறினை எப்படி எழுதுவது என்பது அறிவோம். H-O-H ஆனால் இங்கு குறிப்பிட்டது போன்று இப்படி 180 டிகிரியில் நேராக இந்த ஹைட்ரஜன் இணைந்து இருப்பதில்லை. காரணம் ஆக்ஸிஜனில் உள்ள நான்கு சுதந்திர எலக்ட்ரான்கள். பொதுவாக எலக்ட்ரான்கள் மற்ற எலக்ட்ரான்களைக் கண்டதும் விலகி ஓடும் தன்மை உடையது. அப்படி இந்த சுதந்திர எலக்ட்ரான்கள் கொண்ட ஆக்ஸிஜன், ஹைட்ரஜன் எலக்ட்ரான்களை சற்று விலக்கம் அடையச் செய்கிறது. ஆதலினால் இப்படி நேர்கோட்டில் அமையாமல் சற்று வளைவாக தண்ணீர் மூலக்கூறு அமைகிறது.
O
H H
இணைப்புக் கோடு அமைய உதவும் எலக்ட்ரான்கள் அதிகமாக மற்ற எலக்ட்ரான்களை தள்ளி விடுவதில்லை. சுதந்திர எலக்ட்ரான்கள் மட்டுமே அதிக அளவில் மற்ற எலக்ட்ரான்களை தள்ளிவிடும் ஆற்றல் உடையது. உதாரணமாக போரான் டிரைகுளோரைடு மற்றும் அம்மோனியாவைக் காணலாம். போரானில் சுதந்திர எலக்ட்ரான்கள் இல்லை எனவே அவை முக்கோண வடிவில் குளோரின்கள் இணைந்து காணப்படுகிறது.
Cl
B
Cl Cl
ஆனால் அம்மோனியாவில் நைட்ரஜன் சுதந்திர எலக்ட்ரான்கள் பெற்று இருக்கும் காரணத்தால் இது போன்று அமையாமல் சற்று வித்தியாசமாக அமைகிறது. இதற்கு காரணம் முன்னரே சொன்னது தான்.
N
H H
H
இதுவே கார்பனாக இருக்கும் பட்சத்தில் சுதந்திர எலக்ட்ரான்கள் இல்லாத காரணத்தால் நான்முகனாக காட்சி தருகிறது. இதனை டெட்ராஹெட்ரல் என்பார்கள். மீத்தேன் வாயுவின் அமைப்பு இது.
H
C
H H
H
இந்த அமைப்பின் கோணம் அவ்வளவு வித்தியாசப்படுவதில்லை. போரான் 120, நைட்ரஜன் 107 மற்றும் கார்பன் 104. அப்படிப் பார்க்கப் போனால் எலக்ட்ரான்கள் அத்தனை பலம் கொண்டு தள்ளி விடுவதில்லை என்றுதான் தோன்றும். ஆனால் தண்ணீர் மூலக்கூறில் நிலைமை வேறு. எனவே இரண்டு இரட்டை சுதந்திர எலக்ட்ரான்கள் இருந்தால் விலக்கும் தன்மை சற்று அதிகமே.
இதனால் என்ன பெரிய பிரச்சினை என எண்ணினால் இருக்கிறது. ஒரு மூலக்கூறினை உருவாக்கும்போது அது எப்படி எந்த அமைப்பை பெற்றால் ஒரு ரிசெப்டாரில் சென்று உட்கார முடியும் என பல அரிய விசயங்கள் இருக்கிறது. அதைப் பொருத்தே ஒரு மூலக்கூறு மருந்தாக மாறக்கூடிய சாத்தியக்கூறு இருக்கிறது. எனவே எல்லா மூலக்கூறுகளும் மருத்துவ குணம் பெற்று இருப்பதில்லை.
ஒரு சிறு மாற்றம் செய்தால் போதும் ஒன்றுமில்லா மூலக்கூறு மருந்தாகும் அதைப் போல ஒரு மாற்றம் செய்தால் மருந்தாகும் மூலக்கூறு ஒன்றுமில்லாமல் போகும். இயற்கையைப் போல் மருத்துவ குணம் வாய்ந்த மிகவும் சிரமமான மூலக்கூறுகளை இரசாயன கூடத்தில் செய்ய இயலுவதில்லை. சில தனிமங்கள் மூலக்கூறில் அமைந்து இருப்பதைப் பார்த்தால் எப்படி இதெல்லாம் சாத்தியம் என எண்ணும் அளவிற்கு பல மூலக்கூறுகள் இருக்கத்தான் செய்கிறது. சர்வ சாதாரணமாக இது போன்ற மூலக்கூறுகளை உருவாக்கிட இயற்கை தானாக தேர்ந்தெடுத்த முறை என நாம் நினைத்துக்கொண்டால் நினைத்துக் கொண்டே இருக்க வேண்டியது தான்.
தண்ணீர் மூலக்கூறினை எப்படி எழுதுவது என்பது அறிவோம். H-O-H ஆனால் இங்கு குறிப்பிட்டது போன்று இப்படி 180 டிகிரியில் நேராக இந்த ஹைட்ரஜன் இணைந்து இருப்பதில்லை. காரணம் ஆக்ஸிஜனில் உள்ள நான்கு சுதந்திர எலக்ட்ரான்கள். பொதுவாக எலக்ட்ரான்கள் மற்ற எலக்ட்ரான்களைக் கண்டதும் விலகி ஓடும் தன்மை உடையது. அப்படி இந்த சுதந்திர எலக்ட்ரான்கள் கொண்ட ஆக்ஸிஜன், ஹைட்ரஜன் எலக்ட்ரான்களை சற்று விலக்கம் அடையச் செய்கிறது. ஆதலினால் இப்படி நேர்கோட்டில் அமையாமல் சற்று வளைவாக தண்ணீர் மூலக்கூறு அமைகிறது.
O
H H
இணைப்புக் கோடு அமைய உதவும் எலக்ட்ரான்கள் அதிகமாக மற்ற எலக்ட்ரான்களை தள்ளி விடுவதில்லை. சுதந்திர எலக்ட்ரான்கள் மட்டுமே அதிக அளவில் மற்ற எலக்ட்ரான்களை தள்ளிவிடும் ஆற்றல் உடையது. உதாரணமாக போரான் டிரைகுளோரைடு மற்றும் அம்மோனியாவைக் காணலாம். போரானில் சுதந்திர எலக்ட்ரான்கள் இல்லை எனவே அவை முக்கோண வடிவில் குளோரின்கள் இணைந்து காணப்படுகிறது.
Cl
B
Cl Cl
ஆனால் அம்மோனியாவில் நைட்ரஜன் சுதந்திர எலக்ட்ரான்கள் பெற்று இருக்கும் காரணத்தால் இது போன்று அமையாமல் சற்று வித்தியாசமாக அமைகிறது. இதற்கு காரணம் முன்னரே சொன்னது தான்.
N
H H
H
இதுவே கார்பனாக இருக்கும் பட்சத்தில் சுதந்திர எலக்ட்ரான்கள் இல்லாத காரணத்தால் நான்முகனாக காட்சி தருகிறது. இதனை டெட்ராஹெட்ரல் என்பார்கள். மீத்தேன் வாயுவின் அமைப்பு இது.
H
C
H H
H
இந்த அமைப்பின் கோணம் அவ்வளவு வித்தியாசப்படுவதில்லை. போரான் 120, நைட்ரஜன் 107 மற்றும் கார்பன் 104. அப்படிப் பார்க்கப் போனால் எலக்ட்ரான்கள் அத்தனை பலம் கொண்டு தள்ளி விடுவதில்லை என்றுதான் தோன்றும். ஆனால் தண்ணீர் மூலக்கூறில் நிலைமை வேறு. எனவே இரண்டு இரட்டை சுதந்திர எலக்ட்ரான்கள் இருந்தால் விலக்கும் தன்மை சற்று அதிகமே.
இதனால் என்ன பெரிய பிரச்சினை என எண்ணினால் இருக்கிறது. ஒரு மூலக்கூறினை உருவாக்கும்போது அது எப்படி எந்த அமைப்பை பெற்றால் ஒரு ரிசெப்டாரில் சென்று உட்கார முடியும் என பல அரிய விசயங்கள் இருக்கிறது. அதைப் பொருத்தே ஒரு மூலக்கூறு மருந்தாக மாறக்கூடிய சாத்தியக்கூறு இருக்கிறது. எனவே எல்லா மூலக்கூறுகளும் மருத்துவ குணம் பெற்று இருப்பதில்லை.
ஒரு சிறு மாற்றம் செய்தால் போதும் ஒன்றுமில்லா மூலக்கூறு மருந்தாகும் அதைப் போல ஒரு மாற்றம் செய்தால் மருந்தாகும் மூலக்கூறு ஒன்றுமில்லாமல் போகும். இயற்கையைப் போல் மருத்துவ குணம் வாய்ந்த மிகவும் சிரமமான மூலக்கூறுகளை இரசாயன கூடத்தில் செய்ய இயலுவதில்லை. சில தனிமங்கள் மூலக்கூறில் அமைந்து இருப்பதைப் பார்த்தால் எப்படி இதெல்லாம் சாத்தியம் என எண்ணும் அளவிற்கு பல மூலக்கூறுகள் இருக்கத்தான் செய்கிறது. சர்வ சாதாரணமாக இது போன்ற மூலக்கூறுகளை உருவாக்கிட இயற்கை தானாக தேர்ந்தெடுத்த முறை என நாம் நினைத்துக்கொண்டால் நினைத்துக் கொண்டே இருக்க வேண்டியது தான்.