நோயைத் தீர்ப்பது என்பது தலையாய கடமையல்லவா? அதற்காக எவ்வளவு பணம் செலவாகிறது, எத்தனை பேருடைய உழைப்பு இருக்கிறது! யோசித்துப் பார்த்ததில் ஒன்று மட்டும் தெரிந்தது. இன்ன காரணம்தான் இப்படி ஏற்படுகிறது என்பது மட்டும் எவருக்கும் சரியாகப் புலப்படவில்லை. ஒருவேளை இதனால் இருக்கலாமோ? இதன் மூலமாக இப்படி நடந்து இருக்கலாம் என எண்ணிக்கொண்டே அதனை அடிப்படையாக கொண்டே ஆராய்ச்சி நடந்து கொண்டு இருக்கிறது. ஒவ்வொரு நோயிற்கும் ஒவ்வொரு நோயுடன் தொடர்பு இருக்கிறது. ஒன்றை நாம் சரிசெய்யும் பொழுது அது மறுபடியும் வராமல் இருக்க வேண்டும் ஆனால் அப்படியிருப்பது இல்லை என்பது அனைவருக்கும் தெரியும். அனைத்து நோயிற்கும் மூலம் ஒன்று தான் என வைத்துக் கொண்டு சிந்தனை செய்வோம்! இது குறித்து ஒரு பெரும் ஆய்வு செய்ய வேண்டும் என்ற ஆசை அதிகமாகவே உண்டு. ஆனால் கதை எழுதுவது போல் இது அவ்வளவு எளிதான விசயம் அல்லவே.
வேதியியலைப் பற்றி விவரித்துக் கொண்டு இருக்கும்போது இதனை எழுதுவதன் நோக்கம் தனித்தனி தனிமங்களின் கூட்டமைப்பே மூலக்கூறுகள்! அவைதான் நமது உடலில் ஏற்படும் ஒவ்வொரு செயலுக்கும் அடிப்படை. அதனுடைய நுணுக்கம் தெரிந்துவிட்டால் எல்லாம் புரிந்துவிடும். அப்படியென்றால் இதுவரை நுணுக்கம் தெரிந்து கொள்ளப்படவில்லையா? என்றால் புரிந்து கொள்ளப்படவில்லை எனச் சொல்லலாம். இத்தனை சிக்கலான கட்டமைப்பு எப்படி உருவானது என சிந்திப்பதிலேயே பல காலங்கள் கழிந்து போனது. இனியும் கழிந்து கொண்டு இருக்கிறது.
தனிமங்கள் தனிமங்களாகவே தனியாக இருந்து இருந்தால் இன்று இந்த உயிர் வாழும் தன்மை என்று ஒன்று வந்து இருக்க முடியாது என்பது அறிந்ததுதான். தனித்து ஆக்ஸிஜன் இருந்து இருந்தால் இன்று நாம் சுவாசிப்பது காற்றாக இருக்க முடியாது. ஆக்ஸிஜன் மற்றொரு ஆக்ஸிஜனுடன் இணைந்து ஒரு மூலக்கூறாக இருப்பதன் காரணம் நிலைத்தன்மை என்னும் வேதியியல் தத்துவம். தனித்தன்மையானது அனைத்துக்கும் பொருந்துமா என்றால் இல்லை என்றுதான் கூறமுடியும். ஹீலியம், ஆர்கன் போன்ற வாயுக்கள் தனித்தே இருக்கிறது காரணம் அவை நிலைத்தன்மை அடைய மற்றொரு தனிமத்தை அணுக வேண்டிய அவசியமில்லை. ஆக நிலைத்தன்மை மிகவும் முக்கியமா என்று பார்த்தால் இந்த தனிமங்களை எல்லாம் ஆராய்ந்துதான் பார்க்க வேண்டும் காரணம் நிலைபாடுடைய உலோகங்கள் பொதுவாக தனித்தே காணப்படுகின்றன. நிலைத்தன்மை என்பது என்ன என்றால் s2 p6 அதாவது s அறையில் இரண்டு எலக்ட்ரான்களும் p அறையில் ஆறு எலக்ட்ரான்களும் கடைசி ஆர்பிட்டாலில் இருக்க வேண்டும்.
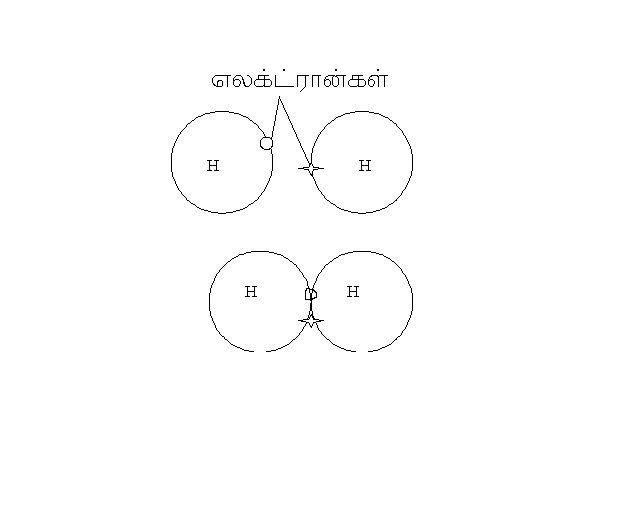
உதாரணமாக ஹைட்ரஜன் எடுத்துக்கொண்டால் அதனுடைய அணு எண் 1 இந்த ஹைட்ரஜன் வேறு ஒரு ஹைட்ரஜனுடன் இணைந்து வெளிவட்ட ஆர்பிட்டாலில் இரண்டு எலக்ட்ரான்கள் என பூர்த்தி நிலை அடைகிறது. இங்கு இரண்டு எலக்ட்ரான்கள் தான் அதிகபட்சம் என்பதை நாம் நினைவில் கொள்ள வேண்டும். எனவே s2 என்னும் நிலைப்பாடு வந்தடைகிறது.
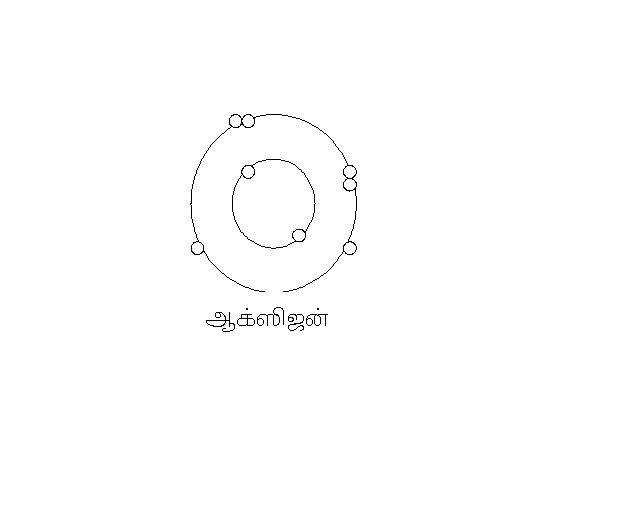
இது போல ஆக்ஸிஜனின் அணு எண் 8. அதனுடைய வெளிவட்ட ஆர்பிட்டாலில் 6 எலக்ட்ரான்கள் இருக்கும். வேறு ஆக்ஸிஜனுடன் இணைந்து எட்டு எலக்ட்ரான்கள் என பூர்த்தி நிலை அடைந்துவிடும்.
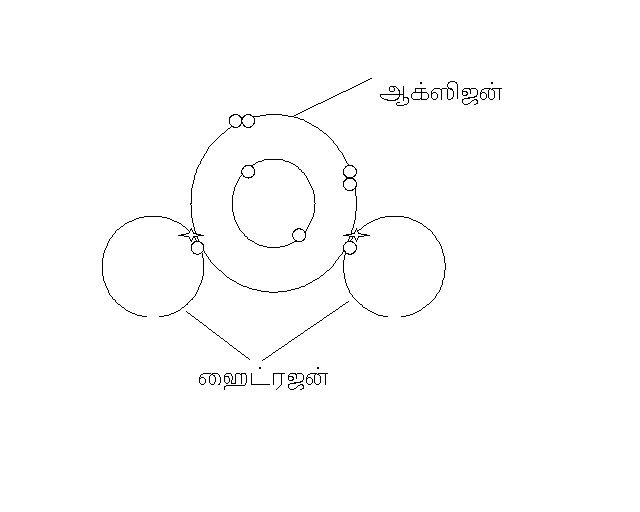
இந்த ஆக்ஸிஜனுக்கு தேவையான இரண்டு எலக்ட்ரான்களை ஹைட்ரஜன் ஒவ்வொரு தனிமமாக இருந்து வழங்கி அது நீராக மாறுகிறது. இது எப்படி எல்லாம் நடைபெறுகிறது என பின்னர் பார்ப்போம்.
ஹைட்ரஜன் தனியாகவும் சேர்ந்தும்.
ஆக்ஸிஜன் தனியாக
ஆக்ஸிஜனும் ஹைட்ரஜனும் இணைந்த பின்னர்
ஒரு தனிமமானது எலக்ட்ரான்களை இழக்கும்போது அது நேர்தன்மை அடைகிறது. ஒரு தனிமமானது எலக்ட்ரான்களை பெறும்போது அது எதிர்தன்மை அடைகிறது. எலக்ட்ரான்களின் பரிமாற்றத்தால் மட்டுமே ஒரு மூலக்கூறு உருவாகிறது. இப்படி மூலக்கூறுகள் உருவாக அணுக்களின் பிணைப்பு இருவகையில் நடைபெறுகிறது. இதனை இப்படி இப்பொழுது சுருக்கி வைத்துக் கொள்வோம்.
மிகவும் யோசிக்க வேண்டிய விசயம், ஒரு தனிமமானது புரோட்டானை இழந்துவிட்டால் அந்த தனிமம் அந்த தனிமமாகவே இருக்க முடியாது! ஆகவே தான் புரோட்டான் கடவுளின் துகள் என கருதப்படுகிறது. ஒரே ஒரு புரோட்டான் கொண்டுள்ள ஹைட்ரஜனை புரோட்டான் இழக்கச் செய்தால் என்ன கிடைக்குமோ?, ஆனால் அந்த தனிமம் ஹைட்ரஜனாக இருக்க முடியாது. இதில் கதிரியக்கமுள்ள தனிமங்கள் பற்றி பின்னர் பார்ப்போம்.
எலக்ட்ரான்கள் பரிமாற்றம் எப்படி எனப் பார்ப்போம்.
சோடியம் 11 எலக்ட்ரான்கள் கொண்டது, இப்பொழுது ஒரு எலக்ட்ரான் இழந்து சோடியம் + ஆகிறது.
குளோரின் 17 எலக்ட்ரான்கள் கொண்டது, இப்பொழுது ஒரு எலக்ட்ரானை பெற்று குளோரின் - ஆகிறது.
அப்படி ஏற்பட்ட பின்னர் இந்த நேர்தன்மையும் எதிர்தன்மையும் கொண்ட பிடிப்பினால் இந்த மூலக்கூறு உருவாகிறது.
அதே வேளையில் மேலே குறிப்பிட்ட படங்களைப் போல் எலக்ட்ரான்களை ஒருவருக்கு ஒருவர் விட்டுக்கொடுத்து நிலைத்தன்மை அடைந்து மூலக்கூறு உருவாகிறது. இது ஆர்பிட்டால் பொருத்து பலமான பலமற்ற பிணைப்பு உருவாகிறது.
மிகவும் யோசிக்க வேண்டிய விசயம், ஒரு தனிமமானது புரோட்டானை இழந்துவிட்டால் அந்த தனிமம் அந்த தனிமமாகவே இருக்க முடியாது! ஆகவே தான் புரோட்டான் கடவுளின் துகள் என கருதப்படுகிறது. ஒரே ஒரு புரோட்டான் கொண்டுள்ள ஹைட்ரஜனை புரோட்டான் இழக்கச் செய்தால் என்ன கிடைக்குமோ?, ஆனால் அந்த தனிமம் ஹைட்ரஜனாக இருக்க முடியாது. இதில் கதிரியக்கமுள்ள தனிமங்கள் பற்றி பின்னர் பார்ப்போம்.
எலக்ட்ரான்கள் பரிமாற்றம் எப்படி எனப் பார்ப்போம்.
சோடியம் 11 எலக்ட்ரான்கள் கொண்டது, இப்பொழுது ஒரு எலக்ட்ரான் இழந்து சோடியம் + ஆகிறது.
குளோரின் 17 எலக்ட்ரான்கள் கொண்டது, இப்பொழுது ஒரு எலக்ட்ரானை பெற்று குளோரின் - ஆகிறது.
அப்படி ஏற்பட்ட பின்னர் இந்த நேர்தன்மையும் எதிர்தன்மையும் கொண்ட பிடிப்பினால் இந்த மூலக்கூறு உருவாகிறது.
அதே வேளையில் மேலே குறிப்பிட்ட படங்களைப் போல் எலக்ட்ரான்களை ஒருவருக்கு ஒருவர் விட்டுக்கொடுத்து நிலைத்தன்மை அடைந்து மூலக்கூறு உருவாகிறது. இது ஆர்பிட்டால் பொருத்து பலமான பலமற்ற பிணைப்பு உருவாகிறது.
(தொடரும்)