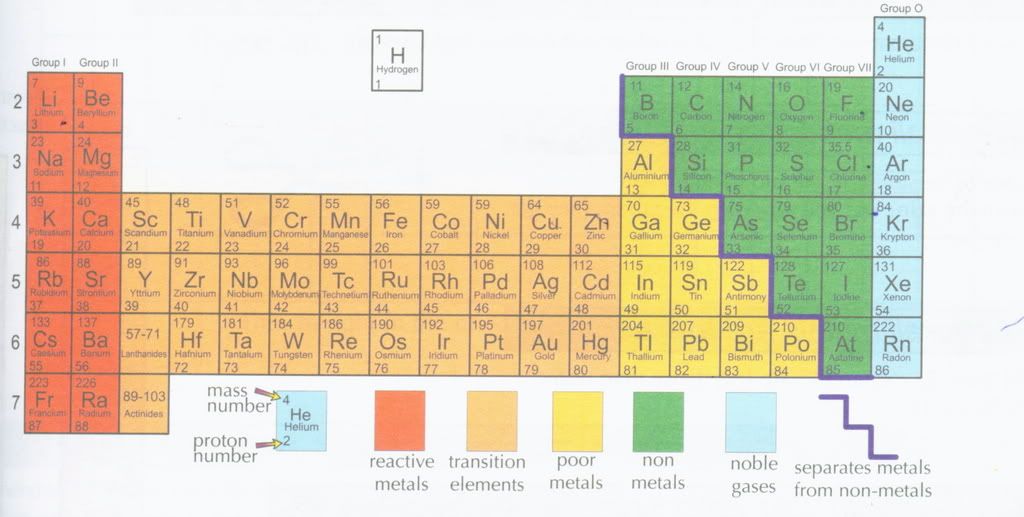
குரூப் (பிரிவு) 1 குரூப் 2 இது s வகையைச் சார்ந்தது. ஹைட்ரஜனும் s வகையில் இருந்தாலும் அது தனித்து காட்டப்படுவது வழக்கமாக இருக்கிறது. குரூப் 3 இல் இருந்து குரூப் 7 வரைக்கும் P வகை எனப்படுகிறது. இடைப்பட்ட வகை d எனச் சொல்வார்கள். லாந்தனைடுகள், ஆக்டினைடுகள் எல்லாம் f வகை. ஆரஞ்சு வண்ணத்தில் இருப்பவை உலோகங்கள், பச்சை வண்ணத்தில் இருப்ப்வை உலோகங்கள் அல்லாதவை, ம்ஞ்சளும், ஆரஞ்சு வண்ணத்திற்கு இடைப்பட்டவை உலோகங்களே, ஆனால் அவை மாற்றம் கொள்ளக்கூடியவை.
அது என்ன வகை அப்படின்னு பார்த்தா முன்ன சொன்னமே, அதுபோல எலக்ட்ரான்கள் இங்க இங்க தான் போய் நிற்கும்னும், அதன்படி இவையெல்லாம் அமைஞ்சிருக்கு. உதாரணமாக சோடியம் எடுத்துக் கொள்வோம் அதனுடைய அணு எண் 11. இப்போ நாம சொன்ன விதிப்படி முதல் மாடி அதாவது K ல s அறையில 2 எலக்ட்ரான்கள் L ல s மற்றும் d ல சேர்த்து 8 ஆக மொத்தம் 10 எலக்ட்ரான்கள். இப்போ பதினொன்வாவது எலக்ட்ரான் M ல s அறையில போய் ஒரு எலக்ட்ரானா போய் நிற்கும் அதுதான் s வகையிகல சோடியம் முதல் குரூப்.
அட்டவணையில் கீழ்நோக்கி 2, 3 ,4 எழுதி இருக்கு இல்லையா அதன்படி சோடியம் 3 வது வரிசையில வரும் காரணம் K, L, ம என்பதில் M மூணாவது மாடி அதுல இருக்கிற அறையில தான் இந்த சோடியத்தோட கடைசி எலக்ட்ரான் இருக்கு. இதன்படிதான் எல்லா தனிமங்களும் இப்படி வரிசைப்படுத்தப்பட்டன.
அணு சொல்றோம், தனிமம் சொல்றோம் என்ன வித்தியாசம்னா, ஒரு தனிமத்தில் ஒரே ஒரு அணுவானது பல அணுக்களாய் சேர்ந்து இருக்கும் அதனால்தான் அது தனிமம். வெவ்வேறு அணுக்கள் சேர்ந்து இருந்தால் அது மூலக்கூறு. பொதுவாக ஹைட்ரஜன், குளோரின், நைட்ரஜன் எல்லாம் இரு அணுக்களாக அதாவது இரண்டு ஹைட்ரஜன் சேர்ந்து இருக்கும் இதனை மூலக்கூறுனு சொல்வாங்க.
இந்த அட்டவணை புரிந்துவிட்டால் அதனுடைய பயன் எல்லாம் எளிதாகிவிடும். எலக்ட்ரான்கள் நிரம்பும் விதம் சக்தியின் அடிப்படையில் எனக் குறிப்பிடப்பட்டு உள்ளது. உதாரணமாக 3d அறை (ஆர்பிட்டால்) 4s அறையை விட சக்தி அதிகமானது ஆகவே எலக்ட்ரான்கள் 3d அறைக்குச் செல்லாமல் 4s அறையினை முதலில் நிரப்புகின்றன. இது மிகவும் முரண்பாடான விசயம் என நினைக்க வேண்டாம். எல்லாம் வகுக்கப்பட்டது, இப்படித்தான் என சொல்லப்பட்டது.
அது என்ன வகை அப்படின்னு பார்த்தா முன்ன சொன்னமே, அதுபோல எலக்ட்ரான்கள் இங்க இங்க தான் போய் நிற்கும்னும், அதன்படி இவையெல்லாம் அமைஞ்சிருக்கு. உதாரணமாக சோடியம் எடுத்துக் கொள்வோம் அதனுடைய அணு எண் 11. இப்போ நாம சொன்ன விதிப்படி முதல் மாடி அதாவது K ல s அறையில 2 எலக்ட்ரான்கள் L ல s மற்றும் d ல சேர்த்து 8 ஆக மொத்தம் 10 எலக்ட்ரான்கள். இப்போ பதினொன்வாவது எலக்ட்ரான் M ல s அறையில போய் ஒரு எலக்ட்ரானா போய் நிற்கும் அதுதான் s வகையிகல சோடியம் முதல் குரூப்.
அட்டவணையில் கீழ்நோக்கி 2, 3 ,4 எழுதி இருக்கு இல்லையா அதன்படி சோடியம் 3 வது வரிசையில வரும் காரணம் K, L, ம என்பதில் M மூணாவது மாடி அதுல இருக்கிற அறையில தான் இந்த சோடியத்தோட கடைசி எலக்ட்ரான் இருக்கு. இதன்படிதான் எல்லா தனிமங்களும் இப்படி வரிசைப்படுத்தப்பட்டன.
அணு சொல்றோம், தனிமம் சொல்றோம் என்ன வித்தியாசம்னா, ஒரு தனிமத்தில் ஒரே ஒரு அணுவானது பல அணுக்களாய் சேர்ந்து இருக்கும் அதனால்தான் அது தனிமம். வெவ்வேறு அணுக்கள் சேர்ந்து இருந்தால் அது மூலக்கூறு. பொதுவாக ஹைட்ரஜன், குளோரின், நைட்ரஜன் எல்லாம் இரு அணுக்களாக அதாவது இரண்டு ஹைட்ரஜன் சேர்ந்து இருக்கும் இதனை மூலக்கூறுனு சொல்வாங்க.
இந்த அட்டவணை புரிந்துவிட்டால் அதனுடைய பயன் எல்லாம் எளிதாகிவிடும். எலக்ட்ரான்கள் நிரம்பும் விதம் சக்தியின் அடிப்படையில் எனக் குறிப்பிடப்பட்டு உள்ளது. உதாரணமாக 3d அறை (ஆர்பிட்டால்) 4s அறையை விட சக்தி அதிகமானது ஆகவே எலக்ட்ரான்கள் 3d அறைக்குச் செல்லாமல் 4s அறையினை முதலில் நிரப்புகின்றன. இது மிகவும் முரண்பாடான விசயம் என நினைக்க வேண்டாம். எல்லாம் வகுக்கப்பட்டது, இப்படித்தான் என சொல்லப்பட்டது.
எலக்ட்ரான்கள் நிரம்பும் வரிசையை எழுதி விடுகிறேன்.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
இதனை கொண்டுதான் ஒவ்வொரு அணுவும் நிர்ணயிக்கப்பட்டு அதனதன் இடத்தில் அமர்ந்துள்ளது. p பின்னர் s வரும்படி அமைந்து இருப்பது ஒரு சிறப்பு, எளிதாக மனதில் வைத்துக் கொள்ள முடியும். உங்களுக்குள் கணக்கு போட்டு பாருங்கள் எப்படி எந்த எந்த அணு எப்படி அமர்ந்திருக்கிறது என.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
இதனை கொண்டுதான் ஒவ்வொரு அணுவும் நிர்ணயிக்கப்பட்டு அதனதன் இடத்தில் அமர்ந்துள்ளது. p பின்னர் s வரும்படி அமைந்து இருப்பது ஒரு சிறப்பு, எளிதாக மனதில் வைத்துக் கொள்ள முடியும். உங்களுக்குள் கணக்கு போட்டு பாருங்கள் எப்படி எந்த எந்த அணு எப்படி அமர்ந்திருக்கிறது என.
எப்படியோ எலக்ட்ரான்கள் அந்த வரிசைப்படி நிரம்பிவிடுகின்றன. தனக்கென பாதை வகுத்துக் கொண்டு வாழப்பழகிக் கொண்டுவிட்டன. தனிமங்கள் ஒவ்வொன்றும் அவ்வளவு எளிதாக கண்டுபிடிக்க முடியவில்லை. பதினைந்துக்கும் குறைவான தனிமங்கள் மட்டுமே நமது மூதாதையர்களுக்கு தெரிந்து இருந்து இருக்கிறது. மற்றதெல்லாம் பின்னால் வந்த அறிஞர்களால் கண்டுபிடித்துச் சொல்லப்பட்டது.
உலோகங்கள், உலோகங்கள் அற்றவை, வாயுக்கள் என ஒவ்வொன்றும் வரிசைப் படுத்தப்பட்டு அதன் அதனுடைய செயல்பாடுகளை பிரித்து வைத்து இன்றைய வேதியியல் நம்முடன் இரண்டற கலந்துவிட்டது. அறிவியலை தனியாக நாம் கற்றுக் கொள்ள வேண்டியதில்லை. நம்மைச் சுற்றி நடக்கும் விசயங்கள் வைத்தே அதனுடைய செயல்முறைகள் விவரிக்கப்பட்டு விளக்கப்பட்டு வந்து இருக்கின்றன.
நியூட்டன் சொன்னது போல் ஒரு விசயத்தைக் குறித்து அவருக்கு இருந்த அளவிலா ஆர்வம் ஒன்றுதான் அவரை உலகத்தில் மறக்க முடியாத மாபெரும் மனிதராக நிலைநாட்டியது அதற்கான அங்கீகாரமும் கிடைத்தது என்பது எவரும் மறக்க முடியாது. ஆர்வம் உள்ள மனிதர்கள் அதனை செயல்படுத்தி அங்கீகாரம் பெரும்போது சாதனையாளர்களாக கருதப்படுகிறார்கள். நாமும் அந்த பட்டியலில் விரைவில் இணையத் தயாராவோம்.
உலோகங்கள், உலோகங்கள் அற்றவை, வாயுக்கள் என ஒவ்வொன்றும் வரிசைப் படுத்தப்பட்டு அதன் அதனுடைய செயல்பாடுகளை பிரித்து வைத்து இன்றைய வேதியியல் நம்முடன் இரண்டற கலந்துவிட்டது. அறிவியலை தனியாக நாம் கற்றுக் கொள்ள வேண்டியதில்லை. நம்மைச் சுற்றி நடக்கும் விசயங்கள் வைத்தே அதனுடைய செயல்முறைகள் விவரிக்கப்பட்டு விளக்கப்பட்டு வந்து இருக்கின்றன.
நியூட்டன் சொன்னது போல் ஒரு விசயத்தைக் குறித்து அவருக்கு இருந்த அளவிலா ஆர்வம் ஒன்றுதான் அவரை உலகத்தில் மறக்க முடியாத மாபெரும் மனிதராக நிலைநாட்டியது அதற்கான அங்கீகாரமும் கிடைத்தது என்பது எவரும் மறக்க முடியாது. ஆர்வம் உள்ள மனிதர்கள் அதனை செயல்படுத்தி அங்கீகாரம் பெரும்போது சாதனையாளர்களாக கருதப்படுகிறார்கள். நாமும் அந்த பட்டியலில் விரைவில் இணையத் தயாராவோம்.
(தொடரும்)
மற்ற பாதைகள் காண பாதை 5தனை காணவும்.


2 comments:
dear sir, i need to talk with you sir, can you give me ur cell number or call me? 81 24 24 8660
மிக்க நன்றி வெள்ளிநிலா. விரைவில் தொடர்பு கொள்வோம்.
Post a Comment